小児の甲状腺結節:経過観察でよいものと精査すべきものの判別、および、いつ、どのようにして実施すべきか
Andrea Corrias, Alessandro Mussa
Torino 大学、Regina Margherita 小児病院、小児内分泌糖尿病科(イタリア、トリノ)
J Clin Res Pediatr Endocrinol 2013.5 :57-69
日本語訳:内部被ばくを考える市民研究会 会員
査読:松崎道幸
【原典】Thyroid Nodules in Pediatrics: Which Ones Can Be Left Alone, Which Ones Must be Investigated, When and How
Andrea Corrias and Alessandro Mussa
<原論文について>
これは、イタリアの医学雑誌J Clin Res Pediatr Endocrinol 2013.5 月号に掲載された小児の甲状腺結節の診断法に関する論文です。小児で甲状腺結節がある場合、どのような検査と診断を実施すべきかを最近の研究報告から検討したものです。著者は、Andrea CorriasとAlessandro Mussa の二人です。Andrea Corrias は、イタリアのトリノにあるReginaMargherita 小児病院の小児内分泌疾患および糖尿病部の医師で、連絡先は、corrando@libero.it (電話:+39 11313585312)です。また著作権は、Galenos Publishing にあります。
<訳文作成した部分>
「謝辞(Acknowledgement)」および「引用文献リスト」は訳出していません。本文中
のカッコ内の数字は、「引用文献リスト」の番号です。また、表1-3については、用語のみ訳出しており、表は掲載していません。図1 はワードでは作成が困難なため、手書き図をスキャンして用語を訳したものを、松崎先生が別紙にてチャート図を作成しました。
<翻訳者について>
下訳は私が2013.6.9に作成し、松崎先生が訂正をされ監訳しました。私が再度読み、松崎先生監訳の内容は変えず、いくつか文章上読みやすくするために変えました。(2014.10.8)
その他、読みやすくするために次の点を変えました。
・段落初めに1字インデントする。
・「のうほう」は「嚢胞」に、「がん」は「癌」に統一する。
以上
2014年10月9日
内部被ばくを考える市民研究会 会員
概要
小児の甲状腺結節の頻度は成人より少ないが、悪性の割合は成人より高い。最近の統計では小児の甲状腺結節の25%が悪性であるとされているため、侵襲的検査が必要である。本総説では、第一段階として、診察、生化学検査、超音波検査を提示する。頸部、頭部、前上胸部の放射線被曝歴、甲状腺疾患あるいは甲状腺腫瘍の家族歴がある場合は、結節が悪性である可能性が高いため、注意が必要である。診察時には、甲状腺機能亢進症の症状および形態異常がみられないかを注意深く観察する必要がある。小児甲状腺がんのおよそ7割に頸部の固いリンパ節腫大が見られ、臨床所見として最も重要である。カルシトニン測定は、どの施設でも必ず行われているわけではないが、散発性あるいは家族性の髄様がんの診断には有効である。数は少ないが、甲状腺機能亢進症状を呈する患者に対しては、甲状腺刺激ホルモン、遊離サイロキシン、遊離トリヨードサイロニンの測定(後者は甲状腺機能亢進症の症状がある場合)と甲状腺シンチグラムを行う。シンチグラムを行うと、甲状腺機能亢進症患者は一般的にアイソトープ摂取量が増大し、中毒性腺腫と診断されることが多い。甲状腺機能が正常かあるいは甲状腺機能低下症(一見無症状である事が多い)の場合、穿刺吸引細胞診(FNAB)が必要である。甲状腺機能が正常か低下している患者では、シンチスキャンを実施しても診断に有効な情報が得られないため、ルーチン検査に含むべきではない。穿刺吸引細胞診の適応となるかどうかは、甲状腺の超音波検査による。超音波検査により良性と悪性を明確に判別できるわけではないが、悪性を疑う指標を得られる。超音波検査により、微小石灰化、リンパ節の変質、レボチロキシン投与による結節の増大、またはカラードップラーにより結節内血管成長の増大が認められる場合は、悪性の可能性が高くなる。エラストグラフィーにより、結節の特徴に関するさらに詳細な情報が得られる、というエビデンスが最近増えている。悪性の可能性があれば必ず穿刺吸引細胞診を実施する。穿刺吸引細胞診の診断精度は約90%であり、手術が必要な患者を選択するために用いる。最近は穿刺吸引細胞診および超音波検査の各々の特異度を上げるために、組織学的マーカーおよびエラストグラフィーが実施されている。穿刺吸引細胞診の欠陥は濾胞性病変の場合であり、腺腫と癌腫の識別は不可能であるため、甲状腺切除がすすめられる。
はじめに
これまでの疫学研究
成人の甲状腺結節の有病率は触診で2~6%、超音波検査では19~35%、剖検では8~65%である(1)。小児および青年期では少ない。近年いろいろな報告がなされているが、小児の甲状腺結節と甲状腺癌に関するものは大半が後顧的研究である。米国における1975 年の大規模な疫学的研究では、触診による小児の結節有病率は1.79%であった(2,3)。もっと近年の報告では、超音波検査による小児の結節有病率は0.2~5.1%であった(4,5)。
最近の報告では甲状腺結節が悪性である割合は、小児では25%、成人では5%である(4.6)。1960~2004 年に出版された16 の研究を検討したNiedziela の報告では、全体的な率は26.4% (9.2~50%)であるが、数字をこのまま鵜呑みにはできない。各研究で採用されている診断方法が共通でないからである。昔の診断方法は理学的検査(触診)であるが、これは今日では主観的手法とされている。現在では超音波検査が一般的となっており、甲状腺結節の有病率が一致して高くなっている(8)。2cm 以上の結節が超音波検査で初めて見つかることはまれではないこと、触診は峡部あるいは前表面部に限局した結節を見つけるのには有効であるが、上極部に限局した結節は大きくても見つけにくいことに注目すべきである。小児と成人のもう一つの相違は、成人では女性の結節保有率が男性よりずっと高いが、小児ではそれほど著明でないことである。
小児の内分泌系のガンは非常にまれであり、内分泌系ガンでいちばん多い甲状腺ガンも小児ガン全体の0.5~3%を占めるにすぎない。米国国立衛生研究所の「監視・疫学・最終結果(SEER)ガン統計調査」によれば1975~2006年における年間発病率は、5-9 歳で100万人に1人、10-14 歳で100万人に5人、15-19 歳で100 万人に18人 である。女子の方が発病率が高く、性比は15 歳以下では3:1、15-19 歳では6:1 と女性優位である(1,9)。
小児の甲状腺癌腫は大半が高分化型である。最近の多施設における甲状腺結節を持つ120人の小児(自己免疫疾患および放射線治療歴のない)の研究報告では、甲状腺癌の発病率は16%であり、組織学的検査結果による内訳は、乳頭癌12%、濾胞癌2.5%、髄様癌1.7%である(3)。これらは通常は増殖がゆっくりであるが、腫瘍が大きい、転移がある、また細胞の異型性が顕著である場合は予後が悪く死亡率が高くなるため、早期診断が必要である(4)。
良性腫瘍は結節全体の約10%であり、この内、中毒性腺腫(プランマー病)(甲状腺機能亢進症を伴う結節性甲状腺腫:訳者注)は治療の対象となるので重要である。小児に甲状腺結節があると診断された場合は、既往歴および曝露歴の聴取、理学的診察、生化学的検査、機器検査などの客観的かつ正確な諸検査を手順を踏んで速やかに実施し、正確な診断を下すことが重要である(表1)。
原因・誘発因子・合併症
甲状腺に結節をきたす疾患には、孤立性甲状腺結節から多結節性甲状腺腺腫まで広範囲の疾患がある。原発性の場合もあるが、既往の甲状腺疾患(自己免疫疾患の場合もそうでない場合もある)に続発する場合もある。甲状腺機能亢進症のような臨床像で発病する場合もあれば、症状はないが、家族に甲状腺疾患があるなど理由で甲状腺や頸部の超音波検査を実施して、偶発的に見つかる場合もある。(4)
甲状腺髄様癌(MTC)では家族性の発症の多いことがよく知られている。またそれ以外の組織型の甲状腺癌でも家族性の発症が見られることがある(9)。甲状腺既往歴があればさらにリスク因子となる。ヨウ素の有機化不全、異所性甲状腺、甲状腺の変則的発生におけるホルモン生成不全による先天的甲状腺機能低下症と、甲状腺舌管嚢胞(通常は組織学的検査で濾胞細胞)においても、甲状腺癌は認められている。成人の甲状腺の自己免疫疾患の研究では、特に乳頭癌における自己免疫疾患と癌との関連が研究されている。甲状腺の自己免疫疾患のある成人患者における甲状腺癌の有病率については、いくつか議論がある。
Daileyらの研究では悪性甲状腺疾患288人の内35人が自己免疫性甲状腺炎を合併していた。彼らは自己免疫性甲状腺炎を前がん状態と考えている。別の研究者によれば、自己免疫性甲状腺炎に甲状腺癌を合併する頻度は1~32%と報告している(11)。この合併率の範囲が広いのは、甲状腺自己免疫疾患および甲状腺癌いずれにおいても、地理的および民族的な差が大きいため考えられる。我々の最近の研究では、自己免疫性甲状腺炎の小児患者365名の内、甲状腺癌が約3%に見つかっている。甲状腺結節がある集団ではその9.6%にがんが合併していたことを報告している(11)。後者の研究では、直径1cm 以上の結節を持つ者のうち、がんが20%にみられた。これは自己免疫性甲状腺炎のない患者での結節で報告されている結果と類似している。そのため、結節の直径が1cm以上の場合は、自己免疫性甲状腺炎患者においても、がんの合併に注意する必要がある。実際にも直径1cm以上が臨床的に警告される分岐点として広く採用されている。また我々の経験では、この目安にもしばしば例外があり、他のリスク要因も考慮する必要がある。
甲状腺癌、特に乳頭甲状腺癌では、電離放射線被曝もよく知られたリスク要因である。
小児の甲状腺は成人よりも電離放射線の発ガン作用への感受性が高い。甲状腺では、他の
放射線誘発性の癌よりも低い線量(0.1Gy のオーダー:100ミリシーベルト程度)でがんが誘発される。高線量(30Gy 以上)では甲状腺癌のリスクが低下するが、これはおそらくがん化する甲状腺細胞自体の死滅によるものであろう(12)。歴史的には、頭部、頸部、胸部の良性腫瘍に低線量放射線治療が広く実施されていた1950~60年代に甲状腺癌発症率が高かったことは、特筆に値する。これに関する初期のDuffy らの研究では(7)、甲状腺癌の小児患者35%に胸腺肥大に対する放射線治療歴があった。小児甲状腺癌は前世紀の初めから1950年代まで増加しその後減少したが、これは放射線による発癌作用が知られ放射線を用いた「治療」が減少したためである(13,14)。
チェルノブイリからのフォールアウトによる電離放射線被曝のエビデンスから、放射線による甲状腺癌発症に関する多くの知見が得られた。甲状腺癌発症の増大が最初に認められたのは小児であり、被爆時の年齢が低いことおよび推定被爆量と甲状腺癌の発症には強い相関性が認められた(15)。とりわけ著しかったのは乳頭がんの増加であり、増殖が早く早期転移が認められた。(16,17)。
小児がんの治療のために放射線照射を受けたこどもでは、若年期に癌性あるいは非癌性の甲状腺疾患にかかりやすいという研究結果が増えている(18)。最初の癌を発症してから6-7年後に甲状腺癌になる場合が最も多く、放射線に関連する甲状腺癌発症のリスクは、最低20年間は上昇が続く(19,20)。放射線治療では、甲状腺癌発症のリスクは20-29Gy までは照射量に比例して高くなるが、これより高い場合は低下する(12)。これらの知見および早期診断により予後が良好となることを考慮して、頭部、頸部、上胸部の放射線治療歴のある小児ガンの回復者では、超音波検査によるスクリーニングを実施することが推奨されている(18)。さらに、がんの化学療法自体がその後の甲状腺がんリスクを増加させる可能性があると言われていることも考慮すべきである(21)
甲状腺の髄様癌および非髄様癌の遺伝学および遺伝
この20~30年の分子生物学的研究により、甲状腺癌の発生に関する多くの重要な遺伝学的プロセスが明らかとなった。甲状腺乳頭癌では、RET/TRK転位あるいはBRAFおよびRAS突然変異のような遺伝的変化により、マイトジェン活性化タンパク質キナーゼ経路にシグナル伝達障害が生じるとされている。このメカニズムは小児で多く見られる(22)。散発性の癌に比べ、放射線被爆歴のある患者の甲状腺癌では、遺伝子の再構成が起きている場合が非常に多い。RET/PTCが最も一般的な遺伝子変異であるが、BRAF/AKAP9も放射線誘発性甲状腺乳頭癌では数多く見られる(23)。RET/PTC遺伝子再構成と癌の進行性の間には関連があるという知見があるが、それが予後と関係するかどうかについては様々な意見がある(24)。濾胞癌で一般的な遺伝変異は、PAX8-PPAR 第三位転座またはRAS変異であり、未分化癌ではCTNNB1およびp53変異が起きているようである(22)。
また小児科医にとっては、甲状腺結節と甲状腺癌に多く見られるかあるいは関連する体細胞に関する知識が非常に重要である。遺伝性の甲状腺癌は、乳頭状腎細胞癌の併発の有無に関わらず非症候性家族性非MTC(純家族性甲状腺乳頭癌を含む)あるいは、多結節性甲状腺腫を伴う乳頭甲状腺癌症の主症状であることが多い。このような患者では、浸透度が不完全である常染色体優性変異を持ち、多嚢胞性乳頭癌を伴う場合が多い。
また小児科医は、甲状腺結節(大半は成長過多あるいは過誤腫性である)を伴い甲状腺以外の腫瘍を伴う傾向の強い遺伝性症候群の存在も念頭に置く必要がある。(表2)。PTEN過誤腫腫瘍症候群は、PTEN腫瘍サプレッサー遺伝子の様々な生殖細胞系の不活性化変異により起こるCowden,Bannayan-Riley-Ruvalcaba, Proteus,Proteus様症候群を含む、様々な疾患の集合である。Cowden症候群の患者は、さまざまな組織、特に子宮、乳房、大腸、甲状腺に、良性および悪性の腫瘍が発生しやすい。これに対し、Bannayan-Riley-Ruvalcaba症候群では、小児科において、大頭蓋、多脂肪腺腫、神経精神運動遅滞が起こることが多く、甲状腺腺腫は自己免疫性甲状腺炎を合併することが多い。男性では、陰茎亀頭の色素過剰沈着斑が典型的にみられる。甲状腺結節は、過形成多結節性甲状腺腫を伴う濾胞性のものが一般的であり、甲状腺癌はそれぞれ50-67%および5-10%に見られる(25)。
多発性腸ポリープ症候群では、甲状腺結節および甲状腺癌を伴うことが多いという文献は多数ある。家族性腺腫様ポリープ症およびその変異系であるガードナー症候群(下顎骨腫、線維腫、脂肪分泌性嚢胞を伴う)は、APC 遺伝子の変異により引き起こされる。Peutz-Jeghers 症候群においても、口唇および口腔粘膜のメラニン班を特徴とする常染色体優生多発性ガストリン過誤腫ポリープ症候群であり、甲状腺癌などの癌のリスクが高くなる。
カーニー複合は、皮膚、乳房、および心臓の粘液腫、皮膚および粘膜色素沈着(黒子症)、
内分泌腺新形成(異常増殖)などを特徴とする常染色体優性疾患である。この疾患は、下垂体腺腫、セルトリ細胞腫、ライデイッヒ細胞腫、色素結節性副腎皮質疾患、および甲状腺多結節性疾患を合併することが多い。甲状腺結節は濾胞性で組織学的には良性である場合が多いが、10-15%は分化型癌であり、PRKAR1-α癌抑制遺伝子の変異によるものが最も多い。
遺伝性疾患の内、McCune-Albright症候群は多発性内分泌および非内分泌癌を特徴とする類似の散発性疾患である。原因はGNAS1の接合後機能獲得型変異であり、多数のG結合レセプターのα―サブユニットがコード化される。臨床症状は、多発性繊維性骨形成異常、皮膚のカフェオレ色素班、思春期早発症の古典的三兆であるが、様々な組織でモザイク様変異が見られ、中毒性甲状腺腺腫、下垂体機能亢進症、クッシング症候群などの他の様々な内分泌系疾患を合併する可能性がある。McCune-Albright症候群では、癌はあまり伴わず、甲状腺ホルモン化分泌を伴う嚢胞あるいは結節を主な特徴とする(26)。甲状腺機能亢進症は、中毒性多結節性甲状腺腺腫に一般的に見られるものであり(27)、稀に新生児甲状腺機能亢進症の原因となることがある。
中毒性多結節性甲状腺腺腫(MTC)は神経堤由来のカルシトニン生成C細胞由来であり、甲状腺腫瘍の約5%がこれにあたる(28)。症例の約20-25%は家族性であり、多発性内分泌癌(MEN)2Aあるいは2B、もしくは純家族性MTC症候群のいずれかの特徴を示す。MEN2症候群はMTCおよび褐色細胞腫の同時発症が特徴である。A型では、さらに副甲状腺機能亢進症を伴う副甲状腺腫瘍が発生し、B型では、粘液性神経腫、神経節神経腫、マルファン症候群体型の併発が典型的である(29)。いずれの型でも、患者はRETガン原遺伝子に特定の変異がある。これら遺伝性症候群ではC細胞過形成が発ガンに先行して引き起こされる。遺伝性疾患の約95%でRETガン原遺伝子の活性化変異が認められる(30)。このような変異はRETの構造的な信号伝達であり、次にカルシトニン過剰分泌を伴うC細胞過形成そして悪性の変化が続く。したがって、カルシトニン検査が、甲状腺結節における随様癌のスクリーニングとして有効である。家族性MTC は、コドン618および620の変異を、またコドン768および804の非システイン変異を通常伴う(31,32)。MEN2Aは、RET遺伝子のエクソン10および11の生殖細胞系変異により起こる。MEN2Bでは、家族性の発症はあまりない。(32)MTCの浸透率はMEN2Aおよび2Bいずれにおいてもほとんど完全であるため、予防的に甲状腺摘出を実施することがすすめられる。実施時期は、遺伝子型および表現型研究に基づいたRET遺伝子の変異により変わってくる(31,33)。カルシトニン値は、甲状腺摘出後の経過観察においても重要な役割を果たす。
他覚症状の検査
診察(理学的検査)癌が示唆される硬く固定化した結節は、触診でわかる。診察あるいは超音波検査で結節が確認された場合は、診察により、1)関連するリンパ節の腫れがあるかどうか、2)甲状腺機能亢進症を示す臨床像があるかどうか(臨床像が認められない場合は甲状腺機能亢進症を排除する)、3)局所圧迫症状があるかどうか、を確認する。したがって診察する医師は、局所的圧迫症状があるかどうかの確認のため、えん下障害、発声障害(嗄声)、不快感、息切れなどの症状がないかどうか、また甲状腺機能亢進症があるかどうかの確認のため、頻脈、脈圧の増大、多汗症、震撼、眼球突出がないかに注意する必要がある。
リンパ節の腫脹は特に重要である。リンパ節が硬い場合は甲状腺癌が強く示唆される。小児の場合は、リンパ節腫大が成人より(訳注:英語原文ではthatだが、thanの誤植であろう)も多く(6,35)、診断症例の78,9%にこの所見があること(36,37)は、極めて重要である。ただし、そうであっても成人より予後が悪いわけではない。結節の数、リンパ節の腫大、シンチスキャンでの摂取量がわずかであること、低エコー輝度、細胞診の結果などのうち、リンパ節の固い腫脹は細胞診の次に重要な甲状腺がんの指標である(36)。理学的所見は、身長、体重の計測も含めもれなく広範囲に実施し、甲状腺結節に関連する特徴的な症状および形態異常を見逃さないようにしなければならない。MEN2症候群の兆候には特に注意を払う必要がある。
血液検査
血液検査の主な目的は、甲状腺機能およびカルシトニン分泌の評価である。甲状腺刺激ホルモン(TSH)、遊離サイロキシン(FT4)、遊離トリヨードサイロニン(FT3)値の測定により、甲状腺機能正常、甲状腺機能低下、甲状腺機能亢進(各々約90%、5%、5%程度の比率)のいずれかを判別することができる。実際、大半の甲状腺結節を持つ症例では、甲状腺機能が正常で全身症状がない。これは甲状腺機能低下症(通常は甲状腺機能低下は無症状)の患者の結節でも同様である。最近、結節の診断においてTSH値が注目されている(38,39,40,41,42,43,44)。TSH値が正常範囲の上半分にある場合は、悪性の可能性がある。これは興味深いが、小児患者グループにおいてさらに確認が必要であり、これを臨床において有効な指標とするには、科学的知見としての証明が必要である。
一方、甲状腺機能亢進症は症状があるのが普通であり、大きな結節を伴うことが多い。甲状腺機能低下症患者の結節は、甲状腺機能が正常な場合と同様の診断上の取り扱いで良いが、甲状腺機能亢進症では、さらに検査が必要である。甲状腺機能が正常あるいは低下している患者では、次にFNABを実施すべきである。シンチスキャンでは得られる情報がほとんどなく、かえって相対的な機能亢進領域が示されるため、甲状腺機能亢進症と誤診される可能性さえある(3)。一方甲状腺機能亢進症患者では、次の鍵となる検査はシンチスキャンである。この検査を行うと、甲状腺機能が活発(Hot nodule)あるいは正常な部分(Warm nodule)と亢進している部分の区別がつきやすいからである。甲状腺機能亢進症患者に見られる結節は、濾胞細胞で構成されるため、悪性であることはまれであり、穿刺細胞(FNAB)は必要ない。しかし、このような結節の約5%に乳頭癌が見出されていることは留意すべきである(4)。中毒性腺腫は小児科文献ではあまり見られず、甲状腺結節をもつこどもの0.7%(45)から5%(3)に見られるのみである。中毒性腺腫では結節の大きさが甲状腺正常者よりも大きいため、圧縮症状が起こることが多い(3)。中毒性腺腫では、甲状腺機能亢進症が有病率0.7%から5%の範囲で起こるのが一般的である(3,7)。後者の場合、シンチスキャンで高程度摂取パターン(hot pattern)を示し、残りの組織は摂取なしとなるのが普通である。このような場合は細胞診ではあまり情報を得られず、手術が最適の処置である(3,6,46)。
カルシトニンはMTCの最も感度の良い診断指標である。MTCのスクリーニングには特に重要である。なぜなら早い時期に診断が可能となるので、良好な予後が期待できるためである。しかし、結節が新たに発見された場合の第一段階としてルーチン検査で実施することには未だに議論がある。大半の研究者がルーチン検査を提唱しているが(48)、そうでない研究者もいる(47)。カルシトニン値の検査は欧州甲状腺協会(ETA)により2006年に推奨された(49)が、米国甲状腺委員会(ATA)では費用対効果に疑問がある(50)としており、推奨されていない(46)。米国内分泌医学会、Associazione Medici Endocrinologi、欧州甲状腺委員会から成るAACE/AME/ETAの甲状腺結節特別委員会(Task Force on Thyroid Nodules)の最近の共同研究でも、甲状腺結節患者についてカルシトニン測定を必須項目とする考えが疑問視されている(51)。しかし、家族性甲状腺髄様癌、MEN2が疑われる場合、また細胞診で髄質がんが示唆される場合は必須である。われわれの経験では小児の甲状腺疾患患者ではカルシトニンの測定を必須項目とすべきと考える。
カルシトニン値を必須測定項目に入れるべきか否かの論議が続いている理由は、主に信頼性のある限界値を設定することが困難だからである。カルシトニン値は年齢、体重、性別により異なること、神経内分泌疾患、肺がん、すい臓癌、腎臓病、高ガストリン血症、甲状腺自己免疫疾患でも分泌が増加するため、偽陽性になる可能性がある。飲酒、喫煙、敗血症、異好性抗カルシトニン抗体が陽性である場合も、カルシトニン値に影響がある。カルシトニン値が上昇している場合は、再検査、あるいは刺激テスト(ペンタガストリンを0.5μg/kgを静脈注射にて投与後、2,5,15分ごとにカルシトニン値を決定する)を実施して確認し(52)、特異度を上げる。(神経内分泌腫瘍、別のタイプの癌、腎不全、膵臓炎、甲状腺疾患などによる)偽陽性が頻繁に生ずるため、この確認テストは必要である。カルシトニンが100pg/mLを越えた場合、MTCを疑う必要があると言われている(52)。
サイログロブリンは高分化型甲状腺癌の感度の良い特異的なマーカーであるため、頸部リンパ結節の洗浄液内のサイログロブリン値が重要となる場合がある。この方法は、かつて甲状腺摘出および放射性ヨウ素治療を受けた患者において、頸部リンパ節への転移の早期発見のために行われていたが、現在では術前のリンパ節転移の早期診断を目的として行われている。特に、甲状腺結節は小さいが大きなリンパ節腫脹が認められる(悪性が強く示唆される)場合に行われることが多い(52,53,54)。頸部リンパ節の細胞診洗浄液のカルシトニン値も、原発性および再発性/転移性の甲状腺髄様癌を診断するための、信頼度の高い指標となる可能性がある(52,54,55)。
超音波検査
甲状腺超音波音波検査は、甲状腺結節を検出するための一次スクリーニング画像手段である(56)。安価、高速、放射線不使用、非侵襲的、取り扱いが簡易であるという理由で、
甲状腺結節の診断および管理の最前線で使用されており、大変有利である。しかし、検査者のスキルによって所見が変わるという欠点もある。また患者は仰臥位になり、頸部を広げ、肩の下に小さなパッドをあてて、頸部の視野を広げる必要がある。頸部に腫瘤がある場合、超音波検査によりどの組織から発生したものかを特定することができる。医師は、頸部の腫瘤には甲状腺結節のように見えて、実はそうではない状態がたくさんあることを認識する必要がある(膿瘍、甲状舌管嚢胞、異所性胸腺、リンパ節あるいは血管の奇形、腫瘍など)。しかし、超音波検査の役割は甲状腺結節の確認にとどまらない。超音波検査は、触診される結節が一つでも、それ以外に結節が隠れていないかどうかを評価して、甲状腺の病期を評価する(いずれのデータも多結節性甲状腺腫の例に有効)ための、基礎となる。また、FNABのガイド、甲状腺切除患者のリンパ節および残存甲状腺組織の状態監視にも有効である。
超音波検査のさらに重要な目的は、結節に悪性の疑いのある患者を選び出し更に検査を実施するための一次スクリーニングにある(56,57,58)。この場合カラードップラーを使用すれば、2モード超音波検査(Aモード:振幅 Bモード:輝度)に比較して結節のより詳細な特徴が得られる。しかし、超音波検査のみでは結節が良性か悪性かの判定は不可能であること、またさらに検査および経過観察が必要であることを認識しておく必要がある。良性か悪性かの指標となるようないくつかの結節の特徴が指摘されている。周囲の正常甲状腺組織の中に低エコー領域がある場合、最も悪性を示唆する所見である(4,46)。しかし、悪性結節の超音波パターンは均一に低エコーを示す場合が多いが、多くの良性結節でも同様のパターンが見られることも事実である。従って、低エコー所見はがんを敏感に拾い出すが、特異性に欠ける。この他に悪性を示す特徴としては、境界が不明瞭であること、内部微細石灰化、結節内高血流、蛇行性内部血管がカラードップラーにより認められる、等がある(4)。結節が孤立性である、皮膜下に限局している、超音波パターンが不均一である場合に、悪性の可能性が高くなるという報告もある(59)。経過観察中に超音波で結節の大きさの増大が認められること、特に増大が、レボチロキシン投与による抑制治療あるいは副抑制治療の期間に認められる場合は、悪性であることが指摘されている(11,60)。
超音波検査で所属リンパ節に異常所見がある場合も悪性の可能性が高くなるため、精査が必要である。リンパ節の縦と横の比率が1.5以下であること(通常は2以上である)、リンパ節の形状が丸いこと、リンパ節門の欠如、不均等な皮質肥厚が認められること、内部エコーの不均質、血流の増大も、悪性の指標として一般的である(3,4,6,46,61,62,63,64)。
穿刺細胞診(FNAB)
FNABは過去30 年間、孤立性甲状腺結節、嚢胞、成人の多結節性甲状腺腺腫中の最大結節の診断の基軸となっている。小児では発生数が少ないため、データも少ない(11,30,65,66,67)。最近の8つの研究では(3,11,36,68)、正診率が75%-95%に達しており、これは成人に匹敵する数字である(69,70,71)。
過去には小児にFNABを実施する際の安全性が問題となっていた。穿刺時の疼痛不快や診断能の低さ、また乳頭状内皮過形成、出血、血管増殖、血栓症、線維化、嚢胞変性、梗塞、膿瘍などの合併症が原因であった(71,72)。しかしごく最近の調査では、FNABを実施した大半の小児患者に合併症は見られなかったという(36,59,73)。それにもかかわらず、FNABが、甲状腺がんの診断、手術適応決定のための最適の検査なのかが問題となっている。FNABが、感度、特異度、精度において、他の方法を上回っているという報告がある(36)。今のところ甲状腺機能正常あるいは甲状腺機能低下症で触診により結節が認められる場合、また結節の大きさが1cm以上で悪性が疑われるような明確な超音波画像が認められる場合は、FNABをすべきであるという考えが主流である。しかし、結節が触診で認められない場合、多結節性甲状腺腺腫の場合、結節が小さい場合、嚢胞病変の場合など他の場合でも、細胞診が必要かどうかについては疑問が出されている。さらに、どのような場合にFNABを繰り返して行うべきかについてもコンセンサスが得られていない。結節が触知されなくても、超音波によりたまたま結節が見つかった場合は細胞診を実施したほうがよいと考える研究者もいる(36)。しかし、これは小児甲状腺癌で最も多い乳頭状癌では、所属リンパ節転移や肺内転移があっても、進行が非常にゆっくりしていることを考えると、侵襲が大きく、やりすぎかもしれない。(74)。触診では分からない結節が癌である確率が極めて低いため、触知可能な結節だけをFNABの対象とすべきであると主張する研究者もいる。しかしこれは、小児よりも癌化率の低い大人を対象とした疫学調査結果(51)に基づく意見であり、結節が小さいからといって癌の可能性が少ないとは言えない小児期の甲状腺には当てはまらない(3)。
結節が1cm以上である場合、増大している場合、特にレボT4投与にもかかわらず増殖する場合(75,76)は、上記のようにFNABが薦められる。しかし、1cm以下の結節でも細胞診を考慮すべきであり(6,11,77、)特に他の悪性腫瘍の治療として頭部、頸部、上胸部の外部放射線照射歴のような危険因子がある場合、超音波検査により悪性が疑われる場合、頸部リンパ節の腫大が疑われる場合は、細胞診を実施すべきである。
悪性腫瘍は孤立性結節として現れる場合が多いが、多結節性甲状腺疾患でも同様な危険がある(3,77,78)。このような場合、疑わしいすべての結節の細胞診を行うべきである。また嚢胞成分をもった結節の5-14%に乳頭癌の発生が報告されているため(59,79)、結節に嚢胞成分があるからがんの心配はないと安心すべきではなく、細胞診を実施すべきである。
次の問題は細胞診を実施するタイミングであり、特に再検査をするかどうかの決定である。多くの臨床医は、前回の細胞診で診断がつかない場合(46)、また特に診察や超音波検査で悪性が疑われる場合には(80)細胞診の再検査が適切だとしている。FNABの適応となるかどうかは疾患の危険性に基づいて判断すべきである。嚢胞性病変ではFNABを実施するかどうか論議が分かれている。病歴、診察、検査所見からがんの可能性が高い結節に対してはFNABが必須である(51)。初回のFNABの結果が良性であった患者を毎年2~12 年間にわたりFNABを実施した結果、その1.3%に乳頭癌が発生したという報告(81)は、注目すべきである。FNABにより多くの不要な手術を回避できる。しかし、甲状腺結節の20%はFNABで確定診断が得られないと推定されている。これらの症例は「疑わしい細胞診断(suspicious cytology)」と言われ、この分類には、瀘胞状新生物(過形成結節、瀘胞状腺腫、瀘胞癌、乳頭癌の瀘胞性異型)(82,83)およびヒュルツル細胞病変7(84)が含まれる。FNABで採取された検体は組織学的に、5段階の危険度に分類される(TYR1-5)(85)。この分類で悪性とされるのはわずか20%であり、残り80%は不要あるいは不適切なタイミングでの手術治療を受けた可能性がある。この診断上の欠陥を補うために、多くの研究者がエラストグラフィー、分子組織学的マーカーなど、また特に最近では18フルオロデオキシグルコースポジトロン放出型断層撮影/CT(18-FDG PET/CT)の併用で正診率が改善するかどうかを検討している。
エラストグラフィーは甲状腺結節の良性と悪性を鑑別するために最近臨床に導入された。この方法は乳房や肝臓の結節の診断にも用いられており、結節組織を通過する弾性波の速度を分析することにより、固形結節の硬さを調べるものである。悪性結節では周囲の組織よりも硬くなっていることが多いという原理による。現在のところ、この方法を甲状腺結節に用いることの有効性を評価した研究は少ないが(45)、甲状腺がんの新たな診断法として大きな可能性があることを示唆する研究結果も報告されている。特に細胞診で診断がつかない時にこの検査を行い、FNAB件数を60%減らすことができたという(51,63,64)。しかし研究者の意見は対立しており、最近の論文ではエラストグラフィーは標準的な超音波より有効とは考えられず、さらに研究が必要だと強調する論文もある(86,87)。
塗布標本により免疫細胞化学を用いて良性と悪性の鑑別をする方法については(88,89)、我々は分化型甲状腺癌のマーカーおよび予測因子のリストを報告している(表3)。この中で、ガレクチン-3、HBME-1、サイトケラチン-19、CD44v6、テロメアーゼ10は(90,91,92)、近年甲状腺癌の判別により信頼性があると考えられている。カルシトニンは髄様癌の信頼できるマーカーと考えられていることは明らかである。しかし、この方法の限界は、どのマーカーも単独では臨床診断の必要をみたせず、信頼できる診断手法とするには全体的なマーカーの把握が必要である。さらに、これらマーカーの研究は大半は成人を対象としたものであり、小児患者を対象とした研究はほとんどない(46)。
最近は分子マーカー(突然変異テスト)を用いて悪性の甲状腺結節の診断効果を高めようとする試みに関心が集まっている。細胞増殖および細胞周期の進行にほとんど常に関わっていることが知られている複数の遺伝子が、悪性の甲状腺結節では変異していることが報告されている。最も関連の強い例としては、小児に多い乳頭状甲状腺癌細胞のBRAF遺伝子に一貫して変異が見られるというものである。他には、RAS遺伝子およびRET/PTC遺伝子に関連した変異が見られる(92)。精密な知見を得るにはさらに研究が必要であるが、分子的アプローチは対費用効果の面でも有効と考えられる(93,94)。
最後に、FNABの結果が疑わしい場合は18-FDG PET/CTが有用な手法として提唱されていることを挙げておく。この手法の臨床応用に関するデータは十分でなく意見も分かれており(95)、この高価な手法の有用性を結論づけることはまだできない。以上の結論として、少なくとも直径1cm 以上の甲状腺結節では、表1に示した診断アルゴリズムに従って診断することが合理的で許容される。結節がこれより小さい場合は、悪性が示唆されるような複数の所見がある場合にのみ細胞診が適応となると考えられる。
小児に対し細胞診で確定できない場合に結節にエラストグラフィーを実施することの妥当性は、まだ今後の研究が必要である。
結論
小児の甲状腺結節は4-5例の内約1例が悪性である。また大半が高分化型である。診断のための精密検査は複合的であり、悪性のリスクの最も大きい結節を選び出すことを目的としている。表1に概略的な診断アルゴリズムを示した。まず診察、超音波検査、臨床検査が必要である。放射線治療歴および甲状腺癌の家族歴がある場合は警戒が必要である。触診で硬い結節が触れる場合やリンパ節の腫脹が認められる場合も、精査が必須である。
超音波検査では結節が良性か悪性か100%の鑑別はできないが、FNABが必要かどうかを判断するうえで貴重な情報が得られる。低エコー、微細石灰化、リンパ節の形態変異、結節内血流の増大がある場合は、悪性が強く示唆される。また、超音波画像診断により、触診で分かる大きさの結節と同じくらいがんの可能性を持った、触診ではわからない小さな結節を見つけ出すことが可能である。血中TSH、fT4、fT3値は、甲状腺機能亢進症を拾い出すために行われる。甲状腺機能亢進があると判明した患者には、次にシンシスキャンを行なってアイソトープ摂取増大を確認する。中毒性腺腫では、細胞診の結果は常に良性であるが、甲状腺機能亢進の症状を緩和するために手術を実施するのが普通である。一方甲状腺機能が正常か低下している場合は、患者が(甲状腺がんがあるかどうかの結果に応じて)手術の適応かどうかを判別するためのFNABが鍵となる。その精度は90%程度である。FNABでも断定できない場合と、瀘胞細胞性病変の場合、この手法でも結論が得られない。後者の場合は、最近導入されているエラストグラフィーおよび最近行われるようになってきた分子マーカーと代謝マーカーの包括的な検査により、診断の精度が上がる可能性がある。
表1 小児甲状腺結節の診断手法に考慮すべき既往・診察・臨床検査・計測データ・既往歴データ
甲状腺癌の家族歴(特に髄様癌)
他の甲状腺疾患の合併
癌の既往歴(特に頭部、頸部、上胸部への放射線照射歴)
臨床データ
甲状腺機能亢進症の自他覚症状
呼吸困難、えん下困難、発声困難、不快感など気道圧縮の症状
触診による結節の大きさおよび特徴
リンパ節腫大の有無、大きさ、特徴
レボチロキシン投与下での結節の増大
甲状腺疾患に特有の症状および形態学的異常
臨床試験データ
甲状腺刺激ホルモン、遊離サイロキシン、遊離トリヨードサイロニン
(甲状腺機能亢進症の症状がある場合)
血中カルシトニン値(基礎値あるいはペンタガストリン負荷試験後、本文参照)
計測データ
超音波
甲状腺
エコーパターン
カラードップラーでの血流
リンパ節
縦/横比率
甲状腺門の概観
被膜浸潤の有無
エコー反射性
エラストグラフィー
シンチグラフィー(甲状腺機能亢進が疑われる場合)
穿刺細胞診(FNAB)
表2 甲状腺結節および甲状腺癌を合併する症候群および遺伝性疾患
症候群 表現型 結節性病変 遺伝学的所見
PTEN- 過誤腫症候群
Cowden
OMIM#158350
良性および悪性腫瘍、子宮・乳房、腸、甲状腺に最も多い
甲状腺結節は通常瀘胞性:過形成多結節性髄様癌および甲状腺癌が各々50-70% および5-10%に見られる
PTEN 腫瘍抑制遺伝子の突然変異による生殖細胞系不活化
Bannayan-Riley-Ruvalcaba
OMIM#153480
大頭症、多発性脂肪腫症、神経精神運動系発達遅延、甲状腺結節、側湾症、てんかん、ミオパチー、血管奇形、関節弛緩症、陰茎亀頭の色素班
甲状腺腺腫は自己免疫性甲状腺炎と関連する可能性あり・甲状腺結節は通常瀘胞型である・過形成多結節性甲状腺腫および甲状腺癌は、各々症例全体の50-67%,5-10%
PTEN 腫瘍抑制遺伝子の突然変異による生殖細胞系不活化
Carney complex
(カーニー複合)
OMIM#160980
皮膚、乳房、心臓の肉腫性粘液腫、皮膚および粘膜の色素沈着異常(黒子症)、内分泌腺異常増殖
甲状腺多発性結節、細胞診では良性の瀘胞性病変である場合が多いが、この内10-15%は分化型癌の可能性がある
常染色体優性疾患・PRKAR1-α腫瘍抑制遺伝子の変異
家族性線腫性ポリープ症
OMIM175100
多発性腸ポリープ、初期は良性だが悪性化の傾向
甲状腺癌のリスク上昇常染色体優性疾患・APC 遺伝子の突然変異
Gardner 症候群
OMIM#175100
多数の腸ポリープ、初期は良性だが悪性化の傾向、下顎骨骨腫、線維腫、皮脂嚢胞
甲状腺癌のリスク上昇
常染色体優性疾患・APC 遺伝子の突然変異
Peutz-Jeghers 症候群
OMIM175200
多発性過誤腫性胃腸ポリープ、口唇および口腔粘膜の黒色班、新生物のリスク増大
甲状腺癌のリスク上昇
常染色体優生STK11 遺伝性の突然変異(生殖細胞系)
MEN 2A
OMIM#171400
甲状腺髄様癌、褐色細胞腫、副甲状腺癌
C 細胞過形成および甲状腺髄様癌
RET 癌原遺伝子の突然変異
MEN2B
OMIM#162300
甲状腺髄様癌、褐色細胞腫、粘膜神経腫、マルファン症候群様体型
C 細胞過形成および甲状腺髄様癌
RET 癌原遺伝子の突然変異
McCune-Albright症候群
OMIM#174800
多骨性繊維性骨異形成症、カフェオレ班、末梢性性早熟症、甲状腺/下垂体/副腎機能亢進症
多発結節/嚢胞中毒性甲状腺腫
GNAS1 遺伝子のモザイク様機能獲得変異
表3 分化型甲状腺癌(穿刺細胞診(FNAB)診断)における分子マーカーおよび予測因子
マーカー 表現型
腺腫 癌腫
E-カデリン ± +
b/g カテニン ± +
サイトケラチン-19 - +
B4 インテグリン - +
HMGI(Y) - +
Fra-1 + +
Ets-1 + +
PAX8/PPARY - +
トポイソメラーゼII - +
thyroperossidasis + -
HBME-1 - +
ケラタン硫酸 - +
ガレクチン-3 - +
CD44v6 ± +
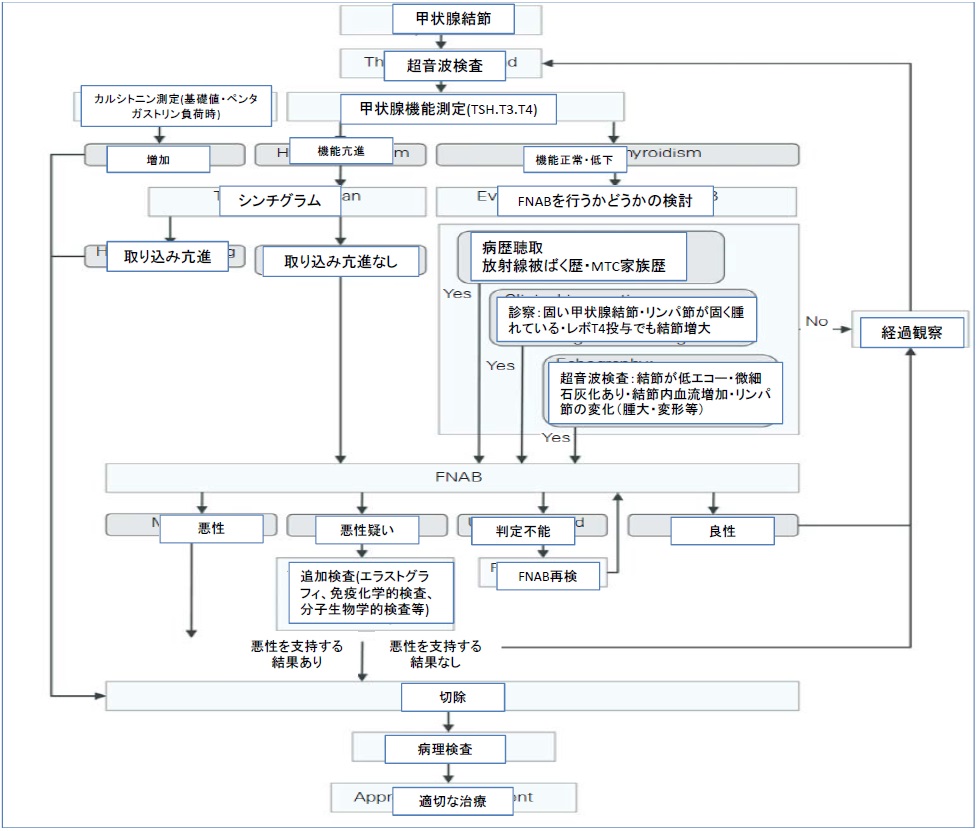
図1 小児甲状腺結節診断アルゴリズム
まず、診察、甲状腺超音波検査、臨床検査を行い、次いで、必要に応じてシンチスキャン(甲状腺機能亢進症の場合)あるいはFNAB(甲状腺機能正常または甲状腺機能低下症の場合)を行う。
*カルシトニン値測定のルーチン化については全般的合意がなされていない(本文参照)*FNAB:穿刺細胞診・T4:遊離サイロキシン・T3:遊離トリヨードサイロニン
MTC:甲状腺髄様癌(medullary thyroid cancer)・レボT4 TSH:甲状腺刺激ホルモン
Corrias A et al.
Assessment of Pediatric Thyroid Nodules
Acknowledgements
The authors are grateful to Prof. Fabio Orlandi from the University of Turin for his precious contribution and help with the review of data concerning the employment of the molecular markers on FNAB cytology, and to Dr. Enrico Brignardello, from the Transition Unit for Childhood Cancer Survivors of the San Giovanni Battista Hospital, Turin, for his valuable suggestions and contribution on matter of the relationship between irradiation and thyroid cancer. We are also grateful to Mr Andrew Martin Garvey for editorial assistance.
References
1. Dean DS, Gharib H. Epidemiology of thyroid nodules. Best Pract Res Clin Endocrinol Metab 2008;22:901-911.
2. Rallison ML, Dobyns BM, Keating FR Jr, Rall JE, Tyler FH. Thyroid nodularity in children. JAMA 1975;233:1069-1072.
3. Corrias A, Mussa A, Baronio F, Arrigo T, Salerno M, Segni M,Vigone MC, Gastaldi R, Zirilli G, Tuli G, Beccaria L, Iughetti L,Einaudi S, Weber G, De Luca F, Cassio A; Study Group for Thyroid Diseases of Italian Society for Pediatric Endocrinology and Diabetology (SIEDP/ISPED). Diagnostic features of thyroid nodules in pediatrics. Arch Pediatr Adolesc Med 2010;164:714-719.
4. Niedziela M. Pathogenesis, diagnosis and management of thyroid nodules in children. Endocr Relat Cancer 2006;13:427-453.
5. Aghini-Lombardi F, Antonangeli L, Martino E, Vitti P, Maccherini D,Leoli F, Rago T, Grasso L, Valeriano R, Balestrieri A, Pinchera A.The spectrum of thyroid disorders in an iodine-deficient community:the Pescopagano survey. J Clin Endocrinol Metab 1999;84:561-566.
6. Dinauer CA, Breuer C, Rivkees SA. Differentiated thyroid cancer in children:diagnosis and management. Curr Opin Oncol 2008;20:59-65.
7. Duffy BJ Jr, Fitzgerald PJ. Thyroid cancer in childhood and adolescence; a report on 28 cases. Cancer 1950;3:1018-1032.
8. Wang C, Crapo LM. The epidemiology of thyroid disease and implications for screening. Endocrinol Metab Clin North Am 1997;26:189-218.
9. Halac I, Zimmerman D. Thyroid nodules and cancers in children.Endocrinol Metab Clin North Am 2005;34:725-744.
10. Dailey ME, Lindsay S, Skahen R. Relation of thyroid neoplasms to Hashimoto disease of the thyroid gland. AMA Arch Surg1955;70:291-297.
11. Corrias A, Cassio A, Weber G, Mussa A, Wasniewska M, Rapa A,Gastaldi R, Einaudi S, Baronio F, Vigone MC, Messina MF, Bal M,Bona G, de Sanctis C; Study Group for Thyroid Diseases of Italian Society for Pediatric Endocrinology and Diabetology(SIEDP/ISPED). Thyroid nodules and cancer in children and adolescents affected by autoimmune thyroiditis. Arch PediatrAdolesc Med 2008;162:526-531.
12. Sigurdson AJ, Ronckers CM, Mertens AC, Stovall M, Smith SA,Liu Y, Berkow RL, Hammond S, Neglia JP, Meadows AT, Sklar CA,Robison LL, Inskip PD. Primary thyroid cancer after a first tumors in childhood the Childhood Cancer Survivor Study): a nested case control study. Lancet 2005;365:2014-2023.
13. Scott MD, Crawford JD. Solitary thyroid nodules in childhood: is the incidence of thyroid carcinoma declining? Pediatrics 1976;58:521-525.
14. White AK, Smith RJ. Thyroid nodules in children. Otolaryngol Head Neck Surg 1986;95:70-75.15. Rabes HM, Demidchik EP, Sidorow JD, Lengfelder E, Beimfohr C,Hoelzel D, Klugbauer S. Pattern of radiation-induced RET and NTRK1 rearrangements in 191 post-chernobyl papillary thyroid carcinomas: biological, phenotypic, and clinical implications. Clin Cancer Res 2000;6:1093-1103.
16. Nikiforov Y, Gnepp DR. Pediatric thyroid cancer after the Chernobyl disaster. Pathomorphological study of 84 cases (1991-1992) from the Republic of Belarus. Cancer 1994;74:748-766.
17. Pacini F, Vorontsova T, Demidchik EP, Molinaro E, Agate L, Romei C, Shavrova E, Cherstvoy ED, Ivashkevitch Y, Kuchinskaya E,Schlumberger M, Ronga G, Filesi M, Pinchera A. Post-Chernobyl thyroid carcinoma in Belarus children and adolescents:comparison with naturally occurring thyroid carcinoma in Italy and
France. J Clin Endocrinol Metab 1997;82:3563-3569.
18. Brignardello E, Corrias A, Isolato G, Palestini N, Cordero di Montezemolo L, Fagioli F, Boccuzzi G. Ultrasound screening for thyroid carcinoma in childhood cancer survivors: a case series. J Clin Endocrinol Metab 2008;93:4840-4843. Epub 2008 Sep 23
19. Ron E, Lubin JH, Shore RE, Mabuchi K, Modan B, Pottern LM,Schneider AB, Tucker MA, Boice JD Jr. Thyroid cancer after exposure to external radiation: a pooled analysis of seven studies.Radiat Res 1995;141:259–277.
20. Acharya S, Sarafoglou K, LaQuaglia M, Lindsley S, Gerald W,Wollner N, Tan C, Sklar C. Thyroid neoplasms after therapeuticradiation for malignancies during childhood or adolescence.Cancer 2003;97:2397–2403.
21. Cohen A, Rovelli A, Merlo DF, van Lint MT, Lanino E, Bresters D,Ceppi M, Bocchini V, Tichelli A, Socie G. Risk for secondary thyroidcarcinoma after hematopoietic stem-cell transplantation: an EBMT Late Effects Working Party Study. J Clin Oncol 2007;25:2449-2454.
22. Yamashita S, Saenko V. Mechanisms of Disease: moleculargenetics of childhood thyroid cancers. Nat Clin Pract Endocrinol Metab 2007;3:422-429.
23. Gandhi M, Evdokimova V, Nikiforov YE. Mechanisms of chromosomal rearrangements in solid tumours: the model of papillary thyroid carcinoma. Mol Cell Endocrinol 2010;321:36-43.Epub 2009 Sep 18
24. Collins BJ, Chiappetta G, Schneider AB, Santoro M, Pentimalli F,Fogelfeld L, Gierlowski T, Shore-Freedman E, Jaffe G, Fusco A.RET expression in papillary thyroid cancer from patients irradiated in childhood for benign conditions. J Clin Endocrinol Metab 2002;87:3941-3946.
25. Harach HR, Soubeyran I, Brown A, Bonneau D, Longy M. Thyroid pathologic findings in patients with Cowden disease. Ann Diagn Pathol 1999;3:331-340.
26. Congedo V, Celi FS. Thyroid disease in patients with McCune-Albright syndrome. Pediatr Endocrinol Rev 2007;4:429-433.
27. Hamilton CR Jr, Maloof F. Unusual types of hyperthyroidism.Medicine (Baltimore) 1973;52:195-215.
28. Massoll N, Mazzaferri EL. Diagnosis and management of medullary thyroid carcinoma. Clin Lab Med 2004;24:49-83.
29. Raue F, Frank-Raue K. Multiple endocrine neoplasia type 2: 2007 update. Horm Res 2007;68:101-104. Epub 2007 Dec 10
30. Kapila K, Pathan SK, George SS, Haji BE, Das DK, Qadan LR. Fineneedle aspiration cytology of the thyroid in children and adolescents: experience with 792 aspirates. Acta Cytol 2010;54:569-574.
31. Eng C, Clayton D, Schuffenecker I, Lenoir G, Cote G, Gagel RF, van Amstel HK, Lips CJ, Nishisho I, Takai SI, Marsh DJ, Robinson BG,Frank-Raue K, Raue F, Xue F, Noll WW, Romei C, Pacini F, Fink M,Niederle B, Zedenius J, Nordenskjold M, Komminoth P, Hendy GN,Mulligan LM, et al. The relationship between specific RET protooncogene mutations and disease phenotype in multiple endocrine neoplasia type 2. International RET mutation consortium analysis.JAMA 1996;276:1575-1579.
32. Learoyd DL, Marsh DJ, Richardson AL, Twigg SM, Delbridge L,Robinson BG. Genetic testing for familial cancer. Consequences of RET proto-oncogene mutation analysis in multiple endocrine neoplasia, type 2. Arch Surg 1997;132:1022-1025.
33. Fialkowski EA, Moley JF. Current approaches to medullary thyroid carcinoma, sporadic and familial. J Surg Oncol 2006;94:737-747.
34. Mazzaferri EL. Management of a solitary thyroid nodule. N Engl J Med 1993;328:553-559.
35. Brink JS, van Heerden JA, McIver B, Salomao DR, Farley DR,Grant CS, Thompson GB, Zimmerman D, Hay ID. Papillary thyroid cancer with pulmonary metastases in children: long-term prognosis. Surgery 2000;128:881-886.
36. Corrias A, Einaudi S, Chiorboli E, Weber G, Crino A, Andreo M,Cesaretti G, de Sanctis L, Messina MF, Segni M, Cicchetti M,Vigone M, Pasquino AM, Spera S, de Luca F, Mussa GC, Bona G.Accuracy of fine needle aspiration biopsy of thyroid nodules indetecting malignancy in childhood: comparison with conventional clinical, laboratory, and imaging approaches. J Clin Endocrinol Metab 2001;86:4644-4648.
37. Viswanathan K, Gierlowski TC, Schneider AB. Childhood thyroid cancer. Characteristics and long-term outcome in children irradiated for benign conditions of the head and neck. Arch Pediatr Adolesc Med 1994;148:260-265.
38. Chiu HK, Sanda S, Fechner PY, Pihoker C. Correlation of TSH with the risk of paediatric thyroid carcinoma. Clin Endocrinol (Oxf) 2012;77:316-322.
39. Fiore E, Vitti P. Serum TSH and risk of papillary thyroid cancer in nodular thyroid disease. J Clin Endocrinol Metab. 2012;97:1134-1145. Epub 2012 Jan 25
40. Fiore E, Rago T, Provenzale MA, Scutari M, Ugolini C, Basolo F, Di Coscio G, Berti P, Grasso L, Elisei R, Pinchera A, Vitti P. Lower levels of TSH are associated with a lower risk of papillary thyroid cancer in patients with thyroid nodular disease: thyroid autonomy may play a protective role. Endocr Relat Cancer 2009;16:1251-
1260. Epub 2009 Jun 15
41. Fiore E, Rago T, Provenzale MA, Scutari M, Ugolini C, Basolo F, Di Coscio G, Miccoli P, Grasso L, Pinchera A, Vitti P. L-thyroxine treated patients with nodular goiter have lower serum TSH and lower frequency of papillary thyroid cancer: results of a cross sectional study on 27 914 patients. Endocr Relat Cancer 2010;17:231-239.
42. Mondal HP, Sen S, Sasmal S, Ghosal PK, Mukhopadhyay SK,Mukhopadhyay M. Clinicopathological correlation of serum TSH in patients with thyroid nodule. J Indian Med Assoc 2011;109:330-338.
43. Haymart MR, Repplinger DJ, Leverson GE, Elson DF, Sippel RS,Jaume JC, Chen H. Higher serum thyroid stimulating hormone level in thyroid nodule patients is associated with greater risks of differentiated thyroid cancer and advanced tumor stage. J Clin Endocrinol Metab 2008;93:809-814. Epub 2007 Dec 26
44. Boelaert K. The association between serum TSH concentration and thyroid cancer. Endocr Relat Cancer 2009;16:1065-1072.Epub 2009 Jul 20
45. Tonacchera M, Pinchera A, Vitti P. Assessment of nodular goitre.Best Pract Res Clin Endocrinol Metab 2010;24:51-61.
46. American Thyroid Association (ATA) Guidelines Taskforce on Thyroid Nodules and Differentiated Thyroid Cancer, Cooper DS,Doherty GM, Haugen BR, Kloos RT, Lee SL, Mandel SJ, Mazzaferri EL, McIver B, Pacini F, Schlumberger M, Sherman SI, Steward DL,Tuttle RM. Revised American Thyroid Association management
guidelines for patients with thyroid nodules and differentiated thyroid cancer. Thyroid 2009;19:1167-1214.
47. Daniels GH. Screening for medullary thyroid carcinoma with serum calcitonin measurements in patients with thyroid nodules in the United States and Canada. Thyroid 2011;21:1199-1207.
48. Costante G, Meringolo D, Durante C, Bianchi D, Nocera M, Tumino S, Crocetti U, Attard M, Maranghi M, Torlontano M, Filetti S.Predictive value of serum calcitonin levels for preoperative diagnosis of medullary thyroid carcinoma in a cohort of 5817 consecutive patients with thyroid nodules. J Clin Endocrinol Metab 2007;92:450-455. Epub 2006 Nov 21
49. Pacini F, Schlumberger M, Dralle H, Elisei R, Smit JW, Wiersinga W; European Thyroid Cancer Taskforce. European consensus for the management of patients with differentiated thyroid carcinoma of the follicular epithelium. Eur J Endocrinol 2006;154:787-803.
50. Costante G, Filetti S. Early diagnosis of medullary thyroid carcinoma: is systematic calcitonin screening appropriate in patients with nodular thyroid disease? Oncologist 2011;16:49-52.Epub 2011 Jan 6
51. Gharib H, Papini E, Paschke R, Duick DS, Valcavi R, Hegedus L,Vitti P; AACE/AME/ETA Task Force on Thyroid Nodules. American Association of Clinical Endocrinologists, Associazione Medici Endocrinologi, and European Thyroid Association Medical guidelines for clinical practice for the diagnosis and management
of thyroid nodules: executive summary of recommendations.Endocr Pract 2010;16:468-475.
52. Elisei R. Routine serum calcitonin measurement in the evaluation of thyroid nodules. Best Pract Res Clin Endocrinol Metab 2008;22:941-953.
53. Massaro F, Dolcino M, Degrandi R, Ferone D, Mussap M, Minuto F, Giusti M. Calcitonin assay in wash-out fluid after fine-needle aspiration biopsy in patients with a thyroid nodule and border-line value of the hormone. J Endocrinol Invest 2009;32:308-312.
54. Costante G, Durante C, Francis Z, Schlumberger M, Filetti S.Determination of calcitonin levels in C-cell disease: clinical interest and potential pitfalls. Nat Clin Pract Endocrinol Metab 2009;5:35-44.
55. Kudo T, Miyauchi A, Ito Y, Takamura Y, Amino N, Hirokawa M.Diagnosis of medullary thyroid carcinoma by calcitonin measurement in fine-needle aspiration biopsy specimens. Thyroid 2007;17:635-638.
56. Goldfarb M, Gondek SS, Sanchez, Lew JI. Clinic-based ultrasound can predict malignancy in pediatric thyroid nodules. Thyroid 2012 Apr 18. Epub ahead of print
57. Yoon JH, Kwak JY, Moon HJ, Kim MJ, Kim EK. The diagnostic accuracy of ultrasound-guided fine-needle aspiration biopsy and the sonographic differences between benign and malignant thyroid nodules 3 cm or larger. Thyroid 2011;21:993-1000. Epub 2011 Aug 11
58. Kabaker AS, Tublin ME, Nikiforov YE, Armstrong MJ, Hodak SP,Stang MT, McCoy KL, Carty SE, Yip L. Suspicious Ultrasound Characteristics Predict BRAF V600E-Positive Papillary Thyroid Carcinoma. Thyroid 2012 Feb 23. Epub ahead of print
59. de los Santos ET, Mazzaferri EL. Thyrotoxicosis. Results and risks of current therapy. Postgrad Med 1990;87:277-278.
60. Corrias A, Mussa A, Wasniewska M, Segni M, Cassio A, Salerno M, Gastaldi R, Vigone MC, Bal M, Matarazzo P, Weber G, De Luca F. Levothyroxine treatment in pediatric benign thyroid nodules.Horm Res Paediatr 2011;75:246-251. Epub 2010 Dec 7
61. Chang YW, Hong HS, Choi DL. Sonography of the pediatric thyroid:a pictorial essay. J Clin Ultrasound 2009;37:149-157.
62. Babcock DS. Thyroid disease in the pediatric patient: emphasizing imaging with sonography. Pediatr Radiol 2006;36:299-308.
63. Rago T, Vitti P. Role of thyroid ultrasound in the diagnostic evaluation of thyroid nodules. Best Pract Res Clin Endocrinol Metab 2008;22:913-928.
64. Rago T, Scutari M, Santini F, Loiacono V, Piaggi P, Di Coscio G,Basolo F, Berti P, Pinchera A, Vitti P. Real-time elastosonography:useful tool for refining the presurgical diagnosis in thyroid noduleswith indeterminate or nondiagnostic cytology. J Clin Endocrinol Metab 2010;95:5274-5280. Epub 2010 Sep 1
65. Stevens C, Lee JK, Sadatsafavi M, Blair GK. Pediatric thyroid fineneedle aspiration cytology: a meta-analysis. J Pediatr Surg2009;44:2184-2191.
66. Roy R, Kouniavsky G, Schneider E, Allendorf JD, Chabot JA,Logerfo P, Dackiw AP, Colombani P, Zeiger MA, Lee JA. Predictivefactors of malignancy in pediatric thyroid nodules. Surgery 2011;150:1228-1233.
67. Altıncık A, Demir K, Abacı A, Bober E, Buyukgebiz A. Fine-needle aspiration biopsy in the diagnosis and follow-up of thyroid nodules in childhood. J Clin Res Pediatr Endocrinol 2010;2:78-80.
68. Wiersinga WM. Management of thyroid nodules in children and adolescents. Hormones (Athens) 2007;6:194-199.
69. Dinauer C, Francis GL. Thyroid cancer in children. Endocrinol Metab Clin North Am 2007;36:779-806.
70. Gharib H. Changing concepts in the diagnosis and management of thyroid nodules. Endocrinol Metab Clin North Am 1997;26:777–800.
71. Gutman PD, Henry M. Fine needle aspiration cytology of the thyroid. Clin Lab Med 1998;18:461-482.
72. Hung W. Solitary thyroid nodules in 93 children and adolescents. A 35-years experience. Horm Res 1999;52:15-18.
73. Degnan BM, McClellan DR, Francis GL. An analysis of fineneedle aspiration biopsy of the thyroid in children and adolescents.J Pediatr Surg 1996;31:903-907.
74. Feinmesser R, Lubin E, Segal K, Noyek A. Carcinoma of the thyroid in children-a review. J Pediatr Endocrinol Metab1997;10:561-568.
75. Gharib H, Mazzaferri EL. Thyroxine suppressive therapy in patients with nodular thyroid disease. Ann Intern Med 1998;128:386-394.
76. Giuffrida D, Gharib H. Controversies in the management of cold,hot, and occult thyroid nodules. Am J Med 1995;99:642-650.
77. Papini E, Guglielmi R, Bianchini A, Crescenzi A, Taccogna S, Nardi F, Panunzi C, Rinaldi R, Toscano V, Pacella CM. Risk of malignancy in nonpalpable thyroid nodules: predictive value of ultrasound and color-Doppler features. J Clin Endocrinol Metab 2002;87:1941-1946.
78. Gandolfi PP, Frisina A, Raffa M, Renda F, Rocchetti O, Ruggeri C,Tombolini A. The incidence of thyroid carcinoma in multinodular goiter: retrospective analysis. Acta Biomed 2004;75:114-117.
79. Papotti M, Volante M, Saggiorato E, Deandreis D, Veltri A, Orlandi F. Role of galectin-3 immunodetection in the cytological diagnosis of thyroid cystic papillary carcinoma. Eur J Endocrinol 2002;147:515-521.
80. Hung W, Sarlis NJ. Current controversies in the management of pediatric patients with well-differentiated nonmedullary thyroid cancer: a review. Thyroid 2002;12:683-702.
81. Orlandi A, Puscar A, Capriata E, Fideleff H. Repeated fine-needle aspiration of the thyroid in benign nodular thyroid disease: critical evaluation of long-term follow-up. Thyroid 2005;15:274-278.
82. Castro MR, Gharib H. Continuing controversies in the management of thyroid nodules. Ann Intern Med 2005;142:926-931.
83. Sclabas GM, Staerkel GA, Shapiro SE, Fornage BD, Sherman SI,Vassillopoulou-Sellin R, Lee JE, Evans DB. Fine-needle aspiration of the thyroid and correlation with histopathology in a contemporary series of 240 patients. Am J Surg 2003;186:702-709.
84. Mijović T, Rochon L, Gologan O, Hier MP, Black MJ, Young J,Payne RJ. Fine-needle aspiration biopsies in the management of indeterminate follicular and Hurthle cell thyroid lesions.Otolaryngol Head Neck Surg 2009;140:715-719. Epub 2009 Mar 12
85. Mehanna HM, Jain A, Morton RP, Watkinson J, Shaha A.Investigating the thyroid nodule. BMJ 2009;338:733. Epub 2009 Mar 13
86. Unluturk U, Erdoğan MF, Demir O, Gullu S, Başkal N. Ultrasound elastography is not superior to grayscale ultrasound in predicting malignancy in thyroid nodules. Thyroid 2012;22:1031-1038. Epub 2012 Aug 9
87. Lippolis PV, Tognini S, Materazzi G, Polini A, Mancini R, Ambrosini CE, Dardano A, Basolo F, Seccia M, Miccoli P, Monzani F. Is elastography actually useful in the presurgical selection of thyroid nodules with indeterminate cytology? J Clin Endocrinol Metab 2011;96:1826-1830. Epub 2011 Aug 24
88. Saggiorato E, De Pompa R, Volante M, Cappia S, Arecco F, Dei Tos AP, Orlandi F, Papotti M. Characterization of thyroid ‘follicular neoplasms’ in fine-needle aspiration cytological specimens using a panel of immunohistochemical markers: a proposal for clinical application. Endocr Relat Cancer 2005;12:305-317.
89. Raggio E, Camandona M, Solerio D, Martino P, Franchello A,Orlandi F, Gasparri G. The diagnostic accuracy of the immunohistochemical markers in the preoperative evaluation of follicular thyroid lesions. J Endocrinol Invest 2009;33:378-381.
90. Saggiorato E, Cappia S, De Giuli P, Mussa A, Pancani G, Caraci P,Angeli A, Orlandi F. Galectin-3 as a presurgical immunocytodiagnostic marker of minimally invasive follicular thyroid carcinoma. J Clin Endocrinol Metab 2001;86:5152-5158.
91. Cochand-Priollet B, Dahan H, Laloi-Michelin M, Polivka M, Saada M, Herman P, Guillausseau PJ, Hamzi L, Pote N, Sarfati E, Wassef M, Combe H, Raulic-Raimond D, Chedin P, Medeau V, Casanova D,Kania R. Immunocytochemistry with cytokeratin 19 and antihuman mesothelial cell antibody (HBME1) increases the diagnostic accuracy of thyroid fine-needle aspirations: preliminary report of 150 liquid-based fine-needle aspirations with histological control. Thyroid 2011;21:1067-1073. Epub 2011 Aug 29
92. Nikiforov YE, Ohori NP, Hodak SP, Carty SE, LeBeau SO, Ferris RL,Yip L, Seethala RR, Tublin ME, Stang MT, Coyne C, Johnson JT,Stewart AF, Nikiforova MN. Impact of mutational testing on the diagnosis and management of patients with cytologically indeterminate thyroid nodules: a prospective analysis of 1056 FNA samples. J Clin Endocrinol Metab 2011;96:3390-3397. Epub 2011 Aug 31
93. Li H, Robinson KA, Anton B, Saldanha IJ, Ladenson PW. Costeffectiveness of a novel molecular test for cytologically indeterminate thyroid nodules. J Clin Endocrinol Metab 2011;96:1719-1726. Epub 2011 Aug 24
94. Yip L, Farris C, Kabaker AS, Hodak SP, Nikiforova MN, McCoy KL,Stang MT, Smith KJ, Nikiforov YE, Carty SE. Cost impact of molecular testing for indeterminate thyroid nodule fine-needle aspiration biopsies. J Clin Endocrinol Metab 2012;97:1905-1912.Epub 2012 Mar 14
95. Deandreis D, Al Ghuzlan A, Auperin A, Vielh P, Caillou B, Chami L,Lumbroso J, Travagli JP, Hartl D, Baudin E, Schlumberger M,Leboulleux S. Is (18)F-fluorodeoxyglucose-PET/CT useful for the presurgical characterization of thyroid nodules with indeterminate fine needle aspiration cytology? Thyroid 2012;22:165-172. Epub 2012 Jan 18